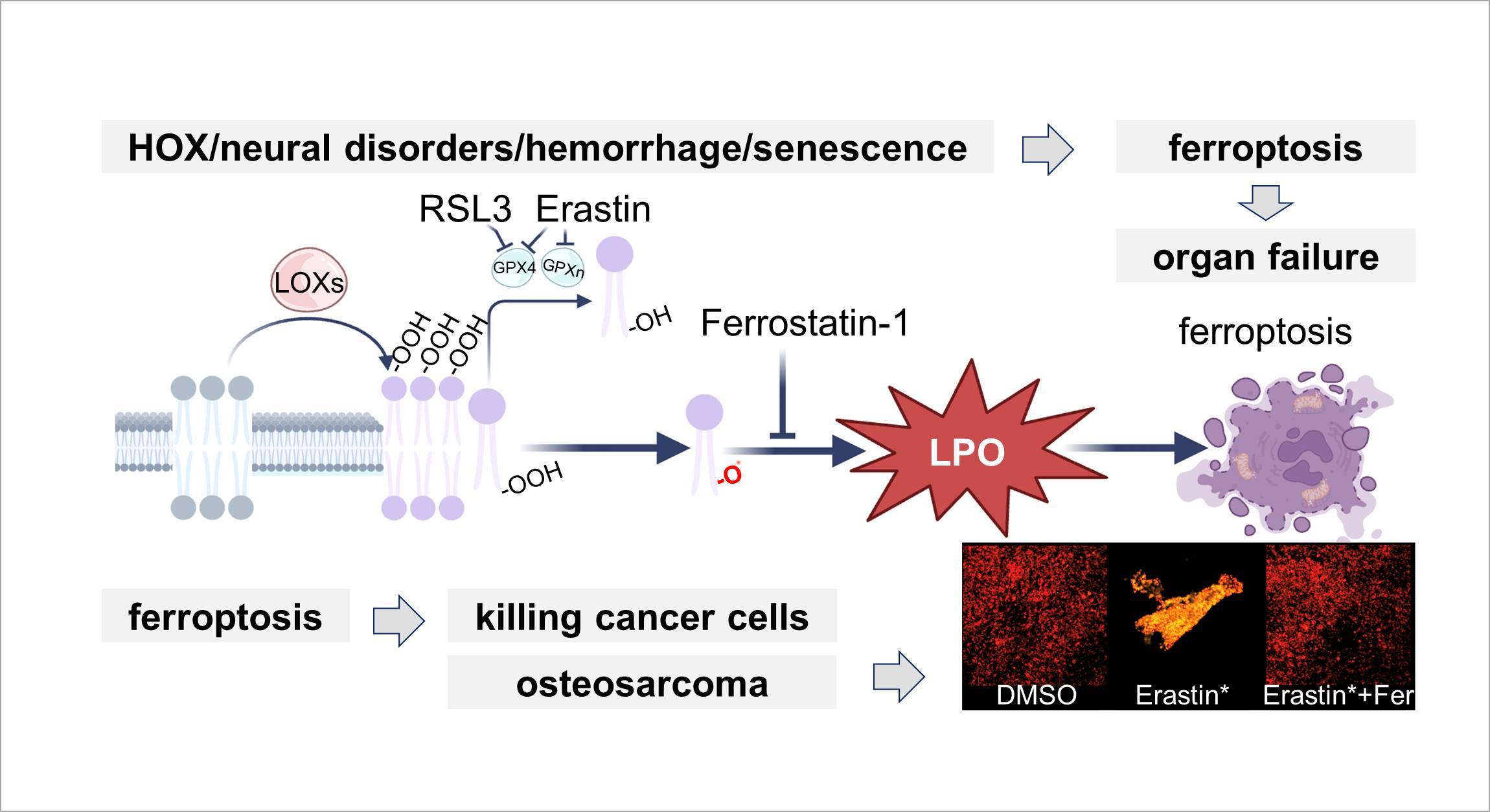
Pathophysiologische Rolle von freien reaktiven Eisenspezies in hypoxischen Geweben bei der Entwicklung von Organversagen
Studien deuten darauf hin, dass Hypoxie, neurale Störungen, Blutungen und Seneszenz die Eisenkonzentration, die Regulierung eisenbezogener Proteine und andere Faktoren beeinflussen, was zur Akkumulierung reaktiver Sauerstoffspezies (ROS) und dem Auftreten von Ferroptose führt. Ferroptose ist eine eisenabhängige Form des regulierten nicht-apoptotischen Zelltods, der zum Organversagen führen kann. Die Bildung von zellulären Lipidhydroperoxiden (LOOH) erfolgt durch einen enzymvermittelten Prozess, der durch (nicht Häm-)eisenabhängige Lipoxygenasen (LOX) katalysiert wird. Ferroptose ist gekennzeichnet durch eine Verringerung des intrazellulären Glutathions und eine verringerte Aktivität der Glutathionperoxidase (GPX), wodurch die Detoxifizierung von LOOH durch Reduktion zu den entsprechenden Lipidalkoholen (LOH) verhindert wird. Ferroptose kann durch pharmakologische Hemmung von GPX induziert werden, beispielsweise mit RSL3 oder Erastin. Ferrostatin-1, ein synthetisches Antioxidans, wirkt über einen reduktiven Mechanismus, um Schäden an Membranlipiden zu verhindern und dadurch den Zelltod zu hemmen. Fluoreszenzbilder zeigen eine Reihe reduzierter und oxidierter BODIPY-C11-Sondensignale mit einem drastischen Anstieg der Lipidperoxidation (LPO) bei Ferroptose. Es zeigt sich, dass Osteosarkomzellen sehr empfindlich auf Ferroptose reagieren, was darauf hindeutet, dass die Induktion von Ferroptose ein potenzielles Mittel zur Bekämpfung von Osteosarkomen ist.