Stickstoffmonoxid-vermittelte Mechanismen von neuronaler Dysfunktion induziert durch Schädel-Hirn Trauma (SHT)
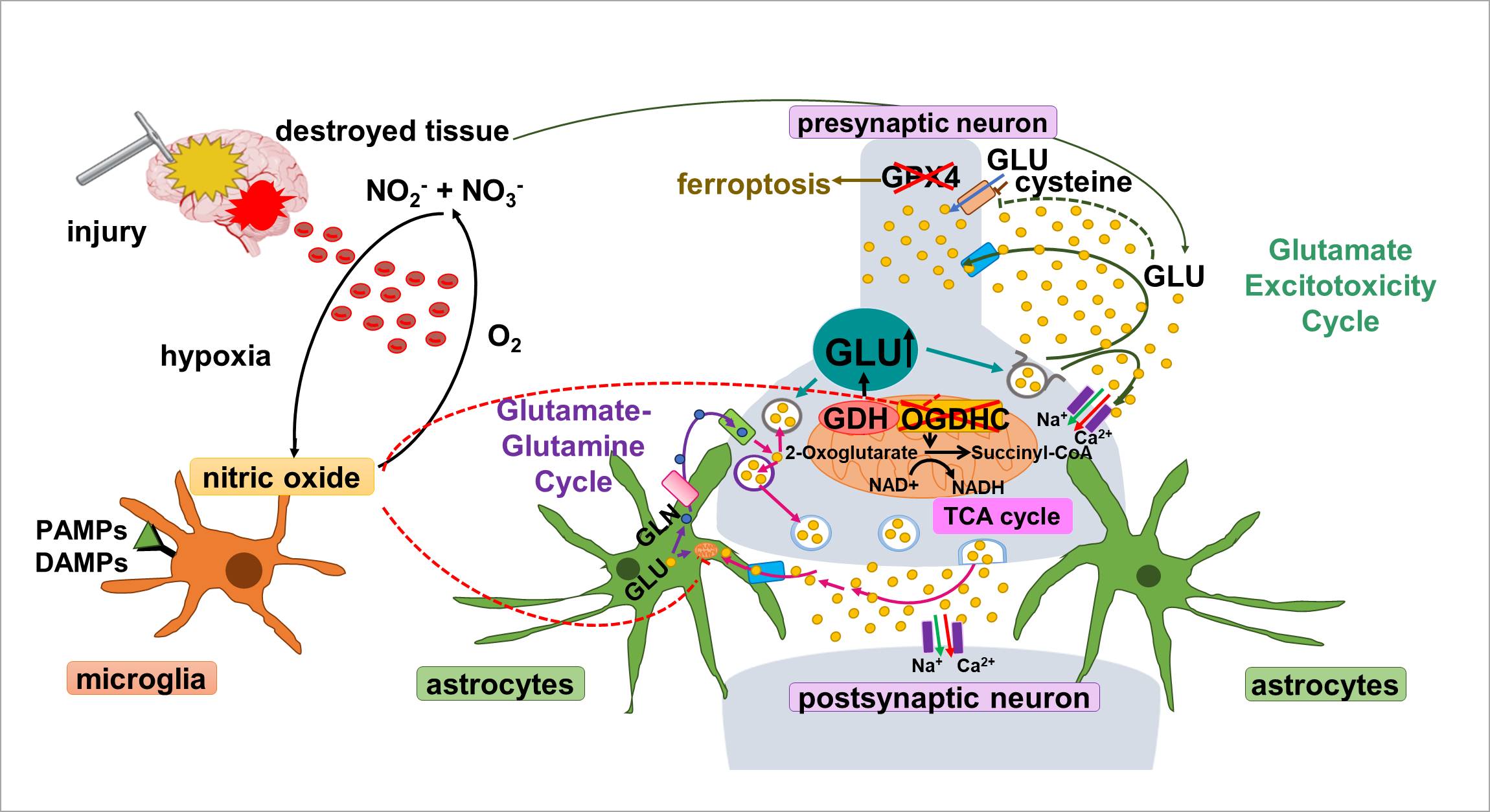
Traumatische Hirnverletzungen sind weltweit eine der Hauptursachen für gesundheitliche Beeinträchtigungen und Behinderungen. Eine der Hauptfolgen im Gehirn ist die Freisetzung von Glutamat und dessen Anreicherung in der extrazellulären Flüssigkeit (EF), die Aktivierung von schädigungs-assoziierten molekularen Mustern (DAMPs) und pathogen-assoziierten molekularen Mustern (PAMPs). In unserer Forschung besteht unser Hauptziel darin, zu untersuchen, welcher Mechanismus für Neurotoxizität und Zelltod zwischen Glutamat-Exzitotoxizität und Ferroptose als Folge der OGDHC-Hemmung in kortikalen Primärzellen besteht.
Bei einigen Patienten mit Schädel-Hirn-Trauma kommt es auch zu einer Subarachnoidalblutung (SAB) mit erhöhten Nitritwerten. Die DAMPs und PAMPs können den Zustand der Mikroglia von inaktiviert zu aktiviert verändern, was zu einer Neuroinflammation führt und die Produktion von Stickoxid (NO) erhöht. Bei Patienten mit SAB und Hypoxie kann Nitrit in NO umgewandelt werden. NO ist ein sekundärer Botenstoff in der Gasphase, der in die Zellen diffundieren und die Aktivität wichtiger Enzyme des Tricarbonsäurezyklus (TCA) in Mitochondrien hemmen kann. Beispielsweise der Oxoglutarat-Dehydrogenase-Komplex (OGDHC), ein Konvergenzpunkt, an dem Glutamat unter physiologischen Bedingungen durch das reversible Enzym Glutamat-Dehydrogenase in 2-Oxoglutarat umgewandelt und im TCA-Zyklus zur Energieerzeugung genutzt wird. Unter pathophysiologischen Bedingungen, wenn das OGDHC-Enzym blockiert ist, kann sich 2-Oxoglutarat ansammeln und wieder in Glutamat umgewandelt werden, was seine intrazelluläre Konzentration erhöht und zu einer Funktionsstörung der Mitochondrien führt. Ein Teil des Glutamats wird in Vesikel verpackt und nimmt an der Signalübertragung teil, der Rest reichert sich im Zytoplasma an und diffundiert in den EF.
Die übermäßige Anreicherung von Glutamat im EF hemmt den Einstrom von Cystein durch den Xc-Antiporter, wodurch die intrazelluläre Cysteinkonzentration und damit die Aktivität des Glutathionperoxidase-Enzyms (GPX) verringert wird, einem Enzym, das normalerweise den oxidativen Stress durch Neutralisierung der Lipidperoxidation reduziert. Die Anreicherung von Lipidperoxiden zusammen mit Eisen führt zur Ferroptose.
Teile dieser Studie wurden bereits veröffentlicht. Ausführliche Informationen dazu finden sie zum Beispiel unter: “Oxoglutarate dehydrogenase complex controls glutamate-mediated neuronal death”, Weidinger et. al., Redox. Biol. 2023 Jun;62:102669. doi:10.1016/j.redox.2023.102669.